Cette expérience a été mise en place en collaboration avec le Chimiscope sur une idée de Luc Schnieper, enseignant de Biologie.
Les eaux des rivières, des fleuves, des mares ou des lacs sont des écosystèmes particuliers, bien souvent très riches en organismes vivants. Non seulement nécessaire pour la consommation, l’eau est utilisée dans diverses activités humaines telles que la baignade, le transport, la production d’énergie, les industries, la pêche et pour y déverser des déchets. La qualité des eaux destinées à la baignade ou à la consommation est déterminée par des critères microbiologiques et chimiques. Ces paramètres sont également de bons indicateurs de la pureté de l’eau et permettent de donner une information importante sur l’écologie d’une rivière, d’une mare ou d’un lac.
L’expérience proposée ici fournit la possibilité d’effectuer les analyses afin de déterminer la pureté d’une eau, d’apprécier sa potabilité et de mettre en évidence les aspects chimiques, biologiquement importants. Cette expérience peut permettre de comparer différents cours d’eau en un temps donné ou d’effectuer différentes analyses au cours du temps sur un même cours d’eau.
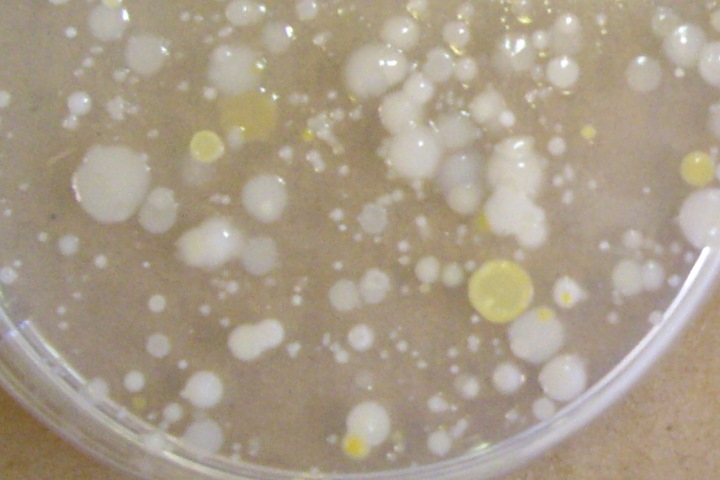
Estimation des germes aérobies mésophiles (GAM).
Ces germes représentent la flore microbienne globale capable de pousser en présence d’oxygène, à une température de 25-30°C sur un milieu riche. Ce sont principalement des bactéries mais certains champignons sont également capables de se développer sur ce milieu riche. En règle générale, plus l’eau contient de matière organique, plus il y aura de GAM.
Du point de vue écologique on considère une eau :
- Très pure, si elle contient moins de 100 UFC/mL
- Encore pure, si elle contient entre 100 et 1000 UFC/mL
- Impure, si elle contient plus de 1000 UFC/mL
Remarques :
a) Le terme UFC signifie Unité Formant Colonies. Après incubation de la boite de pétri, une cellule donne une colonie. Certains micro-organismes forment des amas et dans ce cas, l’ensemble des cellules qui composent cet amas ne formera qu’une seule colonie. C’est pourquoi on utilise le terme d’UFC plutôt que de germes.
b) Pour l’eau de réseau les normes préconisent moins de 300 UFC/mL au robinet. Au-delà il y a un risque trop élevé d’avoir des pathogènes. Mais attention, pour qu’une eau soit considérée potable on doit en plus vérifier l’absence de certains germes et de certains éléments chimique (voir plus bas).
Recherche des indicateurs de contaminations fécales.
Pour qu’une eau soit considérée potable, il faut également s’assurer de l’absence de certains pathogènes entériques. Comme ces germes ont principalement une origine intestinale et que leur recherche n’est pas toujours aisée, il est plus simple de vérifier si l’eau a été souillée par des fèces. Nous recherchons donc dans l’eau la présence de germes que l’on retrouve dans les intestins des animaux à sang chaud. On parle d’indicateurs de contamination fécale. Ces germes ne sont pas nécessairement dangereux mais leur présence dans l’eau indique qu’il y a un risque de trouver des pathogènes. Parmi ces indicateurs il y a : Escherichia coli, un bâtonnet Gram négatif et les Entérocoques qui sont des coques Gram+ également naturellement présent dans nos intestins. Ceux–ci doivent être absents dans 100 mL d’eau. Ils peuvent survivre jusqu’à une semaine dans l’eau mais n’y prolifèrent pas.
Remarque : pour les notions de Gram + et de Gram -, vous pouvez vous référez à l’expérience No 5)
PROTOCOLE
Note: La quantité de matériel est prévue afin d'analyser une seule eau par binôme (soit 2 PCA + 1 coliID par binôme). Si vous souhaitez plus de boites, merci de le préciser.
Attention comme pour l’expérience de mise en évidence des germes de l’environnement (expérience 8), certains micro-organismes peuvent être potentiellement dangereux. Nous vous recommandons de sceller les boîtes avec du ruban adhésif ou du Parafilm par sécurité et de ne jamais ouvrir les boîtes après croissance des micro-organismes.
1) Recherche des GAM
- A l’aide d’un tube Falcon (50 mL) stérile, prélever un échantillon d’eau à analyser. Refermer le tube et le garder à RT jusqu’à l’analyse ou à 4°C (frigo) si l’analyse n’est pas effectuée le même jour.
- Prélever 200 µL de l’eau à analyser et étaler au râteau sur un milieu PCA. Pour la méthode d’étalement au râteau vous pouvez visualiser l’explication en cliquant sur le lien suivant : https://www.youtube.com/watch?v=Px-IVzpTGzo.
- Si l’eau contient beaucoup de germes, il sera difficile de les dénombrer. Afin de s’assurer d’avoir un nombre de colonies comptables, prenez une deuxième boîte PCA et étaler 10 µL comme précédemment.
- Incuber les boîtes à l’envers et à température ambiante pendant 4-5 jours.
- Compter le nombre de colonies et rapporter le résultat par mL. Par exemple si 30 colonies sont comptées dans 200 µL d’eau, cela signifie qu’il y a une concentration de germe de 150 UFC/mL. L’absence de colonie ne signifie pas que l’eau est stérile. Le résultat sera absence de GAM dans 10 ou 200 µL d’eau. Leur concentration peut être inférieure à la limite de détection, ou certains germes peuvent ne pas pousser dans ces conditions.
Exemple de résultats:

Rhône: 10 colonnies/200 ul d'eau, soit 50 UFC/ml Arve: La boite avec 200 ul d'eau n'est pas dénombrable. Environ 30 colonnies dans 10 ul, soit 3000 UFC/ml
2) Recherche d’indicateurs de contamination fécale.
Utilise la même technique d’ensemencement mais en étalant cette fois-ci un milieu sélectif dénommé ColID. Il permet la croissance d’Escherichia coli et d’autres bactéries assez proches que l’on appelle coliformes. Ce milieu ColID est également différentiel. Cela signifie qu’il permet de discriminer les souches d’E. coli qui apparaitront rouges des coliformes qui apparaitront gris-bleues. Les coliformes ne sont pas recherchés pour la potabilité de l’eau. Il existe de nombreuses souches de coliformes naturellement présentent dans l’environnement. Ils étaient autrefois recherchés pour la qualité des eaux de baignade.
- Etaler au râteau 200 µL de l’eau à analyser sur une boîte colID
- Retournez la boîte et incuber 24h à 37°C ou 2 jours à température ambiante.
Remarques :
- Le nombre d’indicateurs de contamination fécale étant plus faible que les GAM, en principe un seul étalement de 200 µL permet de les quantifier. En cas d’analyse d’eau à proximité d’égouts ou de STEP, le volume pourra être diminué.
- La recherche des entérocoques, autres indicateurs de contamination fécale n’est pas effectuée ici. Elle s’effectue de la même manière que précédemment décrit mais en utilisant un milieu de culture sélectif et différentiel spécifique pour leur mise en évidence.
Exemple de résultats:

Rhône: 0 colonies /200 µL d’eau. Les normes pour la potabilité d’une eau étant de 0 E. coli dans 100 mL d’eau, nous ne pouvons rien conclure
Arve: 5 E. coli / 200 µL, ce qui est bien au-dessus de la norme de 0 E. coli dans 100 mL. Ainsi l’eau est considérée impropre à la consommation.
Conclusions des résultats :
L’eau du Rhône (prélevée juste avant la jonction avec l’Arve) est considérée comme très pure. Nous rappelons que ce critère écologique est basé sur le nombre de GAM. A l’opposé, l’eau de l’Arve est impure. Il est important ici de faire le lien avec les paramètres chimiques proposés ci-dessous.
Pour les indicateurs de contamination fécale, aucun E. coli n’a été mis en évidence dans 200 ul d’eau du Rhône. Les normes pour la potabilité d’une eau étant l’absence d’E. coli dans 100 mL d’eau, nous ne pouvons rien conclure. Il faudrait analyser des volumes plus grands, jusqu’à 100 mL si besoin. Cela se fait par filtration des 100 mL sur une membrane afin de récupérer tous les germes présents dans ce volume. La membrane est ensuite déposée directement sur le milieu de culture pour permettre la croissance des germes. Cette étape n’est pas proposée ici. A noter que si 1 seul E. coli est présent dans 100 mL d’eau, celle-ci sera impropre à la consommation bien qu’étant écologiquement « très pure ». Le fait d’avoir la présence d’E. coli indique un risque que des pathogènes entériques soit présents. Pour l’eau de l’Arve, avec 2500 E. coli dans 100 mL, l’eau est clairement impropre à la consommation.
Les paramètres proposés ici pour l’analyse sont les concentrations de phosphate, de nitrite, de nitrate et d’ammonium. La qualité des eaux en Suisse fait qu’à heure actuelle des valeurs très basses de ces paramètres sont observées dans nos cours d’eau. Cependant, à certains endroits ou ponctuellement des valeurs importantes peuvent être décelées suite à des pollutions organiques d’origine urbaines, industrielles ou agricoles. Une méthode plus sensible d’analyses des paramètres chimiques, mise en place par Didier Perret du Chimiscope, sera bientôt disponible. Nous vous tiendrons informé.
Lien pour accéder aux statistiques des analyses des eaux du canton de Genève : http://www.ge.ch/statistique/tel/domaines/02/02_03/T_02_03_5_03.xls
Phosphore, Azote : Normes Suisses
En Suisse, les concentrations moyennes annuelles en phosphore total dans les eaux usées déversées dans les eaux naturelles ne devraient pas dépasser 0.8 mg P/L. Le kit AquaChek pour phosphates mesure la concentration en ortho-phosphates libres (PO43-) mais pas le phosphore total (incluant le phosphore « réfractaire », difficilement hydrolysable). A titre d’exemple, les eaux du Léman contiennent environ 0.02 mg P/L (env. 0.1 mg P/L en 1977-1978), ce qui est encore jugé excessif.
Phosphates: 1 mg PO43-/L correspond à 0.34 mg P-PO43-/L
1 mg P-PO43-/L correspond à 2.9 mg PO43-/L
Les eaux naturelles servant à l’approvisionnement en eau potable ne devraient pas contenir plus que 25 mg NO3-/L (correspondant à 5.6 mg N- NO3-/L) et pas plus que 1 mg NO2-/L (correspondant à 0.3 mg N-NO2-/L)
Nitrates: 1mg NO3-/L correspond à 0.226 mg N-NO3-/L
1 mg N-NO3-/L correspond à 4.43 mg NO3-/L
Nitrites: 1 mg NO2-/L correspond à 0.304 mg N-NO2-/L
1 mg N-NO2-/L correspond à 3.29 mg NO2-/L
Pour les eaux usées déversées dans les eaux naturelles, la concentration d’ammonium ne devrait pas excéder 0.5 mg NH4+/L (correspondant à 0.4 mg N-NH4+/L).
Ammonium: 1 mg NH4+/L correspond à 0.78 mg N-NH4+/L
1 mg N-NH4+/L correspond à 1.29 mg NH4+/L
PROTOCOLE
Pour ces analyses, les kits AQUACHEK vont être utilisés. Veuillez lire attentivement les précautions d’utilisation :
Précautions d'utilisation du Kit Aquachek:
- Fermer hermétiquement les tubes de bandelettes entre chaque utilisation et stocker les tubes au sec et à température ambiante ; chaque analyse coûte environ CHF 0.80/bandelette
- Éviter le contact des coussinets de test avec la peau ; en cas de contact, rincer abondamment
- Estimer la concentration lorsque la couleur du coussinet tombe entre les couleurs de la gamme
- Les gammes de couleurs sur les tubes de bandelettes sont plus précises que celles indiquées ci-dessous
- Après utilisation, ne pas jeter les bandelettes dans la nature ou dans une poubelle à déchets conventionnels ; les récupérer pour élimination via la filière des déchets chimiques
3) Analyse des phosphates PO43-
Kit AquaChek (Hach #27571-50 Water Quality Strips for Phosphate)
Gamme de concentration: 0-50 mg PO43-/L (0-50 ppm PO43-)
- Tremper une bandelette de test dans l’échantillon durant 5 secondes.
- Maintenir la bandelette hors de l’eau durant 45 secondes à l’horizontale, coussinet de test vers le haut, sans agiter et sans éliminer l’excès d’eau sur le coussinet
-
Comparer la couleur du coussinet à la gamme de couleurs sur le tube ou ci-dessous

4) Analyse de l'azote sous forme de nitrites N-NO2- et de nitrates N-NO3-
Kit AquaChek (Hach #27454-25, Water Quality Test Strips for Nitrate/Nitrite)
Gamme de concentrations Nitrite NO2- : 0-3 mg N-NO2-/L (0-3 ppm N-NO2-)
Gamme de concentrations Nitrates NO3- : 0-50 mg NO3- + NO2-/L (0-50 ppm N-NO3-+NO2-)
- Tremper une bandelette de test dans l’échantillon durant 1 seconde
- Maintenir la bandelette hors de l’eau durant 30 secondes à l’horizontale, coussinets de test vers le haut, sans agiter et sans éliminer l’excès d'eau sur les coussinets
- Comparer la couleur du coussinet inférieur à la gamme de couleurs sur le tube ou ci-dessous (échelle inferieur de couleur ; mesure a)
- Après 60 secondes hors de l’eau, comparer la couleur du coussinet supérieur à la gamme de couleurs sur le tube ou ci-dessous (échelle supérieure de couleurs ; mesure b)
- Le test Nitrates mesure la somme des Nitrites NO2- et des Nitrates NO3- présents dans l’échantillon

5) Analyse de l'azote ammoniacal N-NH4+
Kit AquaChek (Hach #27553-25, Water Quality Test Strips for Ammonia)
Gamme de concentrations : 0-6 mg N-NH4+/L (0-6 ppm N-NH4+)
- Remplir l’éprouvette avec l’échantillon jusqu’au trait supérieur
- Tremper une bandelette de test dans l’échantillon et agiter cette bandelette vigoureusement de
haut en bas durant 30 secondes, en prenant soin que les 2 coussinets de test restent immergés - Retirer la bandelette de l’éprouvette et éliminer l’excès d’eau sur les coussinets
- Maintenir la bandelette hors de l’eau durant 30 secondes à l’horizontale, coussinets vers le haut
- Retourner la bandelette, coussinets vers le bas, et comparer par transparence la couleur du coussinet supérieur à la gamme de couleurs sur le tube ou ci-dessous

Exemple de résultats: La valeur 0 signifie en dessous du seuil de détection
| Phosphate (mg/L) | Nitrite (mg/L) | Nitrate (mg/L) | Ammonium (mg/l) | |
| Rhône | 5 | 0 | 0 | 0.25 |
| Arve | 5 | 0 | 0 | 0 |
Matériel fourni:
- Boite de pétri PCA
- Boite de pétri ColID
- Tubes plastique 50 ml
- Micropipettes P20
- Micropipettes P200
- Micropipettes P1000
- Boîte de pointes jaunes
- Boîte de pointes bleues
- Boîte pipettes Pasteur pour les étalements
- Cuillère de mesure
- Tube de mesure 5ml
- Echelle de couleurs
- Réactifs analyses chimiques
Matériel non fourni:
L’Université de Genève décline toutes responsabilités en cas de dommages survenus durant les expériences.